脊髄小脳変性症最新治療の開発動向
脊髄小脳変性症治療薬ロバチレリンの第III相臨床試験
キッセイ薬品工業が開発する脊髄小脳変性症治療薬「ロバチレリン(KPS-0373)」の追加第III相臨床試験が2025年3月に開始されました。この薬剤は、国際的に用いられているSARAスコアにより脊髄小脳変性症における運動失調に対して初めて改善効果が検証された薬剤として注目されています。
ロバチレリンの開発経緯は複雑で、当初2021年12月に製造販売承認申請が行われましたが、医薬品医療機器総合機構(PMDA)より承認困難との見解が示され、2023年7月に申請が一旦取り下げられました。しかし、追加臨床試験の実施可能性についてPMDAとの協議を重ね、新たな臨床試験計画が受け入れられたことから、現在の第III相試験に至っています。
今回の臨床試験では、脊髄小脳変性症患者を対象に、ロバチレリンを経口投与したときの運動失調の改善効果について、プラセボに対する優越性を二重盲検法により検証します。この薬剤が承認されれば、脊髄小脳変性症患者にとって初の根本的治療選択肢となる可能性があります。
現在使用されている対症療法薬には、プロチレリン酒石酸塩(ヒルトニン®)の注射液やタルチレリン水和物(セレジスト®)の錠剤がありますが、これらは症状の緩和に留まっており、疾患の進行抑制効果は限定的です。
脊髄小脳変性症L-アルギニン治療の第2相試験結果
新潟大学を中心とする研究グループが実施したL-アルギニンによる脊髄小脳失調症6型(SCA6)に対する第2相臨床試験の結果が2024年11月に発表されました。この試験は日本国内5施設で実施され、40人の患者が参加した二重盲検無作為化試験として行われました。
48週間の治療後、症状評価スケールSARAスコアの変化を調査した結果、L-アルギニン群では0.96点の改善を示したのに対し、プラセボ群では0.56点の悪化が見られました。両群の差から、L-アルギニンにより約1.5点分の治療効果が示されましたが、統計的有意差には僅かに届かない結果(p=0.0582)となりました。
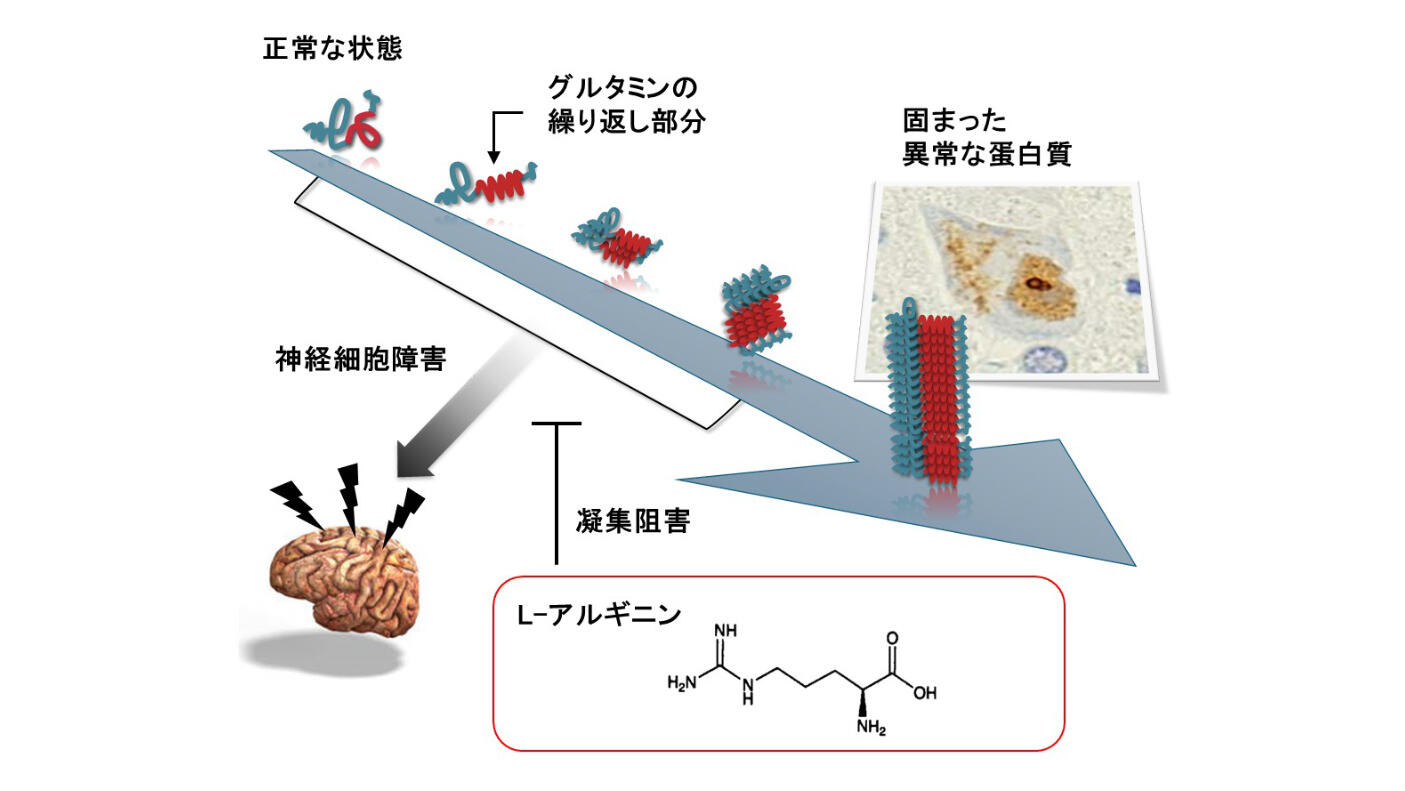
L-アルギニンの作用機序は、ポリグルタミン蛋白質の凝集を抑制することにあります。脊髄小脳失調症の多くは、グルタミンというアミノ酸が異常に長く繰り返されるポリグルタミン蛋白質が神経細胞内で集まり、固まることが原因とされています。L-アルギニンは分子シャペロン効果により、この蛋白質の固まりの形成を阻害し、動物モデルでの治療効果が既に報告されています。
L-アルギニンは既に医薬品として使用されているアミノ酸の一種であるため、安全性プロファイルが確立されており、今後のより大規模な第3相試験の実施が期待されています。
脊髄小脳変性症遺伝子治療の新たなアプローチ
脊髄小脳変性症に対する遺伝子治療の分野では、革新的なアプローチが複数開発されています。特に注目すべきは、東京医科歯科大学の研究グループが報告したRpA1遺伝子治療と、東京大学医科学研究所のmiRNAを用いた治療法です。
RpA1遺伝子治療
東京医科歯科大学を中心とする研究グループは、DNA損傷修復に関わるRpA1タンパク質を用いた遺伝子治療法を開発しました。RpA1には正規型RpA1複合体(RpA1、2、3の複合体)と代替型RpA1複合体(RpA1、3、4の複合体)の2種類があり、正規型はDNA損傷修復を促進してCAGリピートを短縮する一方、代替型は逆にCAGリピート伸長につながることが明らかになりました。
疾患モデルマウスにRpA1を導入する遺伝子治療を行ったところ、小脳で主に正規型RpA1複合体が活性化し、CAGリピートが短縮して症状改善につながることが確認されています。
miRNAによる遺伝子治療
東京大学医科学研究所の村松慎一特任教授らは、シカゴ大学と共同でmiR-3191-5pというmicroRNAを用いた脊髄小脳失調症6型(SCA6)の遺伝子治療法を開発しました。この治療法は、有害なα1ACTタンパク質の翻訳のみを選択的に抑制するという画期的なアプローチです。
SCA6では、CACNA1A遺伝子がカルシウムチャネルαA1と転写因子α1ACTの両方をコードしており、伸長した配列を伴うα1ACTが神経細胞障害の原因となっています。miR-3191-5pは、α1ACTタンパク質への翻訳を選択的に抑制し、改良型アデノ随伴ウイルス(AAV)ベクターを使用してSCA6モデルマウスに導入すると、神経細胞の脱落が抑制され運動機能が改善することが示されています。
その他の治療候補物質
熊本大学の研究グループは、D-システインという哺乳類の生体内では合成されないD体アミノ酸が脊髄小脳失調症の治療薬候補となることを発見しました。3種類の脊髄小脳失調症モデル細胞を用いた実験で、初代培養小脳プルキンエ細胞の形態異常がD-システインの処置で抑制され、SCA1型のマウスモデルでは進行性の運動障害と小脳組織の異常がD-システインの慢性投与で抑制されることが明らかになっています。
脊髄小脳変性症幹細胞療法ステムカイマルの開発
再生医療の分野では、株式会社リプロセルが開発する間葉系幹細胞製品「ステムカイマル®」の臨床開発が進行しています。この治療法は、脊髄小脳失調症3型(SCA3)と6型(SCA6)の患者を対象とした第II相臨床試験が日本国内で実施されており、国際的にも日本、台湾、米国、韓国でグローバルに開発が展開されています。
ステムカイマル®の第II相臨床試験では、全被験者において重篤な有害事象は認められず、安全性が確認されています。有効性評価については、主要評価項目であるSARAスコアによる評価が継続中です。間葉系幹細胞は、損傷した神経組織の修復や炎症の抑制、神経保護因子の分泌などの多面的な作用により、脊髄小脳変性症の病態改善に寄与すると考えられています。
幹細胞療法の利点は、患者自身の細胞を使用することで免疫拒絶反応のリスクが低いことと、神経変性疾患に対する根本的なアプローチが可能であることです。ただし、治療効果の持続性や最適な投与方法については、今後の長期観察データの蓄積が必要です。
台湾ではステミネント社が主導して開発を進めており、米国でも同様の臨床試験が計画されています。韓国ではSCM Life science社が独占的に開発を行っており、アジア太平洋地域での治療選択肢として期待されています。
脊髄小脳変性症治療における予防医学的アプローチ
脊髄小脳変性症治療の新たな潮流として、発症前診断と早期介入による予防医学的アプローチが注目されています。日本神経学会では、将来的に治療法が開発されることを念頭に、遺伝の可能性のある人を対象とした発症前診断を行い、その結果に基づいて早期治療につなげていく検討が進められています。
発症前診断の意義
遺伝性脊髄小脳変性症は日本で約1万人(全体の約1/3)を占めており、家族歴のある患者では遺伝子検査による発症前診断が可能です。発症前診断により、以下のような利点が期待されます。
- 症状出現前からの治療介入による進行抑制
- 生活習慣の改善による発症遅延
- 家族計画に関する適切な情報提供
- 心理的サポートの早期開始
早期介入戦略
現在開発中の治療法が実用化された場合、発症前からの治療開始により、より効果的な治療成果が期待できます。特に遺伝子治療やL-アルギニンなどの疾患修飾療法は、神経変性が進行する前に開始することで、より大きな治療効果を示す可能性があります。
運動療法とリハビリテーション
薬物療法と並行して、運動療法やリハビリテーションの重要性も再認識されています。集中的リハビリテーションプログラムでは、6週間の集中治療後に6か月間の家庭でのサポート付き運動プログラムを実施し、機能的改善を持続させる効果が報告されています。また、反復経頭蓋磁気刺激(rTMS)と理学療法の組み合わせや、神経筋電気刺激(NMES)などの新しいアプローチも有効性が示されています。
多職種連携の重要性
脊髄小脳変性症の包括的な管理には、神経内科医、リハビリテーション科医、言語聴覚士、理学療法士、作業療法士、ソーシャルワーカーなどの多職種連携が不可欠です。特に言語・嚥下障害に対するLee Silverman Voice Treatment(LSVT)や、調整された呼吸技術と発声トレーニングなどの専門的介入により、患者のQOL向上が期待できます。
脊髄小脳変性症の治療は、従来の対症療法中心から疾患修飾療法への転換期を迎えており、医療従事者には最新の治療動向を把握し、患者に適切な治療選択肢を提供することが求められています。今後数年間で複数の治療法が臨床応用される可能性が高く、継続的な情報収集と症例経験の蓄積が重要となるでしょう。
参考:キッセイ薬品工業による脊髄小脳変性症治療薬の詳細情報
参考:新潟大学脳研究所のL-アルギニン治験結果
参考:脊髄小脳変性症・多系統萎縮症診療ガイドライン2018
https://www.neurology-jp.org/guidelinem/sd_mst/sd_mst_2018.pdf
