剤形変更のルール
剤形変更のルールと処方箋の記載要件
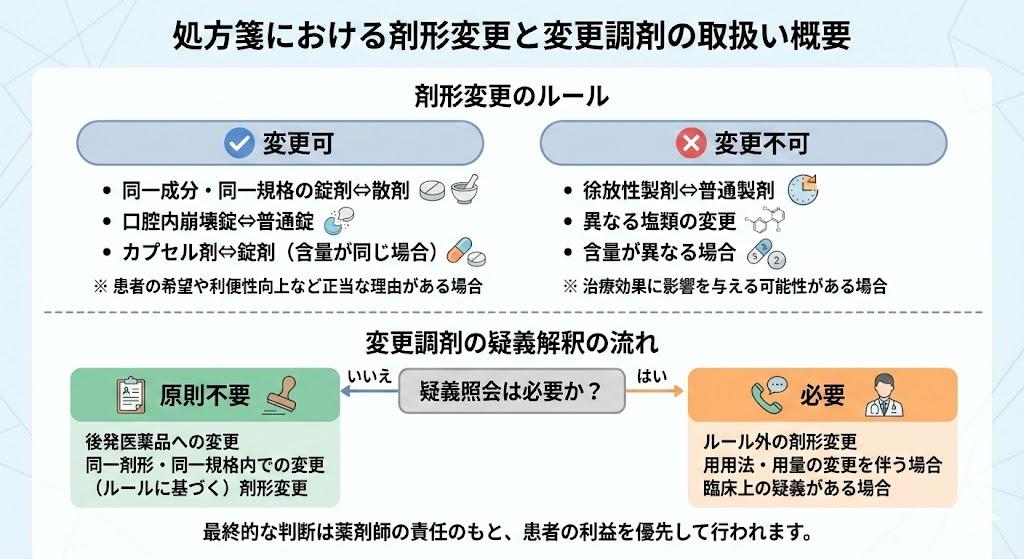
薬剤師が日常業務において頻繁に直面する課題の一つに、処方箋に基づいた剤形変更のルールの適用があります。この判断を誤ると、薬剤師法違反になるだけでなく、患者への健康被害や返戻のリスクを招くことになります。まず、大前提として理解しておかなければならないのは、薬剤師法第24条の規定です。この法律では、処方箋を交付した医師の同意を得ずに、処方箋に記載された医薬品を変更して調剤してはならないと定められています。しかし、医療現場の効率化と患者の利便性向上、さらには後発医薬品(ジェネリック医薬品)の使用促進を目的として、一定のルールの下で薬剤師の判断による「変更調剤」が認められています。
処方箋の記載要件における最大のポイントは、「変更不可」のチェック欄です。処方箋の様式には、個々の医薬品ごとに「変更不可」を指示する欄が設けられています。ここに医師によるチェック(「✓」または「×」)があり、かつ署名または記名・押印がある場合は、いかなる理由があっても薬剤師独自の判断で変更することはできません。この場合、剤形変更のルールを適用するためには、必ず医師への疑義照会が必要となります。一方で、この欄に記載がない場合、または「変更不可」の指示がない場合は、後発医薬品への変更調剤の一環として、含量規格の違いや類似する別剤形への変更が認められています。
ここで重要になるのが、「類似する別剤形」の定義です。厚生労働省の通知(平成24年3月5日 保医発0305第12号など)によれば、内服薬における錠剤、カプセル剤、散剤、顆粒剤などは、相互に変更可能な「類似する別剤形」の範囲に含まれると解釈されています。例えば、嚥下機能が低下した患者に対して、処方された錠剤を散剤に変更することは、患者の同意を得た上で、医師への事後報告を行うことを条件に認められるケースがあります。ただし、この変更はあくまで「後発医薬品への変更調剤」の枠組みの中で議論されることが多く、先発医薬品のまま剤形のみを変更する場合(例:先発錠剤から先発散剤へ)は、厳密には疑義照会が必要となることが一般的です。
また、外用薬に関してはより慎重な判断が求められます。軟膏、クリーム、ローションなどの基剤の違いは、主成分の皮膚への浸透性や使用感、副作用のリスクに大きく影響するため、これらは原則として「類似する別剤形」とはみなされず、変更には疑義照会が必須となります。湿布薬におけるテープ剤とパップ剤の変更についても同様で、剥がれやすさや経皮吸収率が異なるため、安易な変更は避けるべきです。
処方せんに記載された医薬品の後発医薬品への変更について(厚生労働省)
剤形変更のルールと疑義解釈の落とし穴
剤形変更のルールを運用する際、多くの薬剤師が迷うのが「疑義解釈」の細かなニュアンスです。特に、「含量規格が異なる医薬品」への変更については、誤った解釈が広まりやすい領域です。ルール上は、処方された規格がない場合や、患者の服薬アドヒアランス向上のために、合計の成分量が一致するように規格を変更することは認められています。例えば、10mg錠1錠を5mg錠2錠に変更することは、用法・用量が変わらない範囲であれば可能です。しかし、この逆、つまり5mg錠2錠を10mg錠1錠に変更することは、分割投与の意図(朝夕で調整するなど)がないかを確認する必要があり、慎重な判断が求められます。
疑義解釈において特に注意が必要なのは、「剤形変更」と「自家製剤加算」や「嚥下困難者用製剤加算」との関連性です。よくある誤解として、錠剤を粉砕して散剤として調剤する場合と、最初から散剤に変更調剤する場合の区別が曖昧になっているケースがあります。
剤形変更のルールに基づき、錠剤から(製品として存在する)散剤へ変更調剤した場合は、あくまで通常の調剤となりますが、錠剤を粉砕した場合は、製剤的な加工が加わるため、安定性データの確認が不可欠となります。
さらに、剤形変更のルールにおける「価格」の制約も忘れてはなりません。変更調剤の基本的な要件として、患者の負担が増えないこと、つまり「変更後の薬剤料が変更前と同額以下であること」が求められていました。しかし、近年の医薬品供給不足の影響を受け、必ずしもこの原則が守れないケースが出てきています。これについては後述しますが、基本原則としては「高くなる変更」は認められないという点を再認識しておく必要があります。
また、疑義解釈では「先発医薬品から先発医薬品への剤形変更」についての取り扱いも重要です。現行のルールでは、医師の変更不可指示がない場合でも、薬剤師の判断で変更できるのは「後発医薬品への変更」に伴うものが主軸です。つまり、先発品の錠剤から、同じ先発品のOD錠(口腔内崩壊錠)への変更であっても、厳密には疑義照会を行うことが推奨されるケースが多いのです。なぜなら、先発品同士の変更は「後発医薬品の使用促進」という変更調剤の本来の趣旨から外れるためです。ただし、OD錠への変更は患者の嚥下困難を改善する正当な理由があるため、多くの医療機関では包括的に許可されていることもありますが、法的な建付けとしてはグレーゾーンが存在することを認識し、地域の医師会や薬剤師会での取り決めを確認しておくことが重要です。
- 変更可能な例:
- 通常錠 → OD錠(後発品への変更を含む場合)
- カプセル剤 → 錠剤(後発品への変更を含む場合)
- 10mg 1錠 → 5mg 2錠(合計量が同じで用法が変わらない場合)
- 変更不可(疑義照会必須)な例:
- 内服薬 → 外用薬
- クリーム剤 → 軟膏
- 普通錠 → 腸溶錠(吸収部位が変わるため)
剤形変更のルールと変更調剤の定義の違い
「変更調剤」と「剤形変更」は現場で混同されがちですが、剤形変更のルールを正しく適用するためには、この二つの定義を明確に区別する必要があります。変更調剤とは、処方箋に記載された医薬品を、成分含量が同一の別の医薬品(主に後発医薬品)に変えて調剤することを指す広い概念です。その中の一つの手法として「剤形の変更」が含まれています。
変更調剤の定義において最も重要なのは、「成分の同一性」です。しかし、ここにも落とし穴があります。有効成分が同じであっても、「塩」の種類が異なる場合(例:アムロジピンベシル酸塩とアムロジピンマレイン酸塩)は、原則として変更調剤の対象となりますが、適応症に違いがある場合は注意が必要です。また、剤形変更のルールにおいては、単に形を変えるだけでなく、添加剤の違いによる患者のアレルギー歴への配慮も「変更調剤」を行う薬剤師の責任範囲となります。
特に注意が必要なのが、徐放性製剤や腸溶性製剤などの特殊な製剤設計がなされている医薬品です。これらは、単なる「錠剤」や「カプセル」という区分け以上に、薬物動態学的な特性が重視されます。例えば、徐放性錠剤を普通の錠剤に変更してしまうと、血中濃度が急激に上昇し、副作用のリスクが高まる可能性があります。したがって、剤形変更のルール上は「類似する別剤形」に見えても、製剤学的特性が異なる場合は変更調剤を行うべきではありません。このようなケースでは、必ず医師に疑義照会を行い、医学的な判断を仰ぐ必要があります。
さらに、変更調剤の定義には「患者への説明と同意」が不可欠です。薬剤師が専門的知識に基づいて「こちらの剤形の方が飲みやすい」と判断しても、患者が慣れ親しんだ形や色、味でないと飲めないという心理的なバリアが存在することがあります。
剤形変更のルールは、あくまで「変更することができる」という権限を与えているに過ぎず、「変更しなければならない」わけではありません。患者のコンプライアンスを最優先に考え、あえて変更しないという判断も、高度な専門職としての薬剤師の重要な役割です。
項目 変更調剤(ジェネリック変更) 純粋な剤形変更(同一先発品内など) 目的 医療費削減、安定供給確保 服薬アドヒアランス向上、嚥下補助 疑義照会 原則不要(変更不可以外) 原則必要(プロトコル等ある場合除く) 対象範囲 含量違い、類似剤形を含む 類似剤形、粉砕など 患者同意 必須 必須 剤形変更のルールと供給不安時の特例対応
近年、医薬品の供給不安定が慢性化しており、これに伴い剤形変更のルールにも特例的な措置が取られています。これは、従来の「後発医薬品への変更調剤」の枠組みを大きく超えるものであり、現場の薬剤師にとって非常に重要な情報です。
通常、変更調剤は「先発医薬品から後発医薬品」への変更、または「後発医薬品から別の後発医薬品」への変更が基本でした。しかし、2023年以降の事務連絡等により、後発医薬品の入手が困難な場合に限り、「後発医薬品から先発医薬品(長期収載品)」への変更調剤が、医師への事前確認なしで認められるケースが増えています(変更不可の記載がない場合に限る)。これは、患者への薬剤提供を途絶えさせないための緊急避難的な措置であり、従来の「薬剤料が安くなること」という原則が一時的に緩和されていることを意味します。
この特例下における剤形変更のルールの適用例として、以下のようなケースが挙げられます。
- 処方された後発品の錠剤が出荷停止になったため、在庫のある先発品の錠剤に変更する。
- 処方された後発品のOD錠が入手できないため、在庫のある後発品の普通錠(または先発品)に変更する。
このような状況下では、薬剤師は「在庫管理」と「臨床判断」の両方を瞬時に行う必要があります。特に、OD錠から普通錠へ戻すような「逆方向の剤形変更」は、患者にとって飲み込みにくくなるデメリットを伴うため、丁寧な説明と、必要に応じて簡易懸濁法などの代替手段の提案が求められます。また、この特例を適用した場合は、調剤録や薬剤服用歴管理指導簿に、変更の理由(供給困難のため等)を明確に記載しておくことが、後の監査や個別指導において重要となります。
さらに、この供給不安に伴う特例は、地域や時期によって厚労省からの事務連絡が更新される可能性があるため、常に最新の情報をキャッチアップしておく必要があります。
剤形変更のルールは固定されたものではなく、医療需給のバランスによって流動的に変化するものであるという認識を持つことが、これからの薬剤師には不可欠です。
剤形変更のルールと嚥下困難に関する意外なリスク
剤形変更のルールを駆使して、嚥下困難な患者のために錠剤を散剤やシロップ剤に変更することは、一見すると患者利益に直結する良い介入に見えます。しかし、ここにはあまり語られない「バイオアベイラビリティ(生物学的利用能)の変動」と「感覚的拒絶」という意外なリスクが潜んでいます。これが検索上位にはあまり出てこない、独自視点の重要なポイントです。
まず、バイオアベイラビリティの問題です。一般的に、錠剤と散剤が「生物学的同等性」を有しているとされる場合でも、それはあくまで健常成人の空腹時単回投与などの試験結果に基づいています。高齢者や消化管機能が低下している患者において、錠剤を散剤に変更することで、胃内での溶解速度や吸収速度が微妙に変化し、予期せぬ血中濃度の変動(Cmaxの上昇やTmaxの短縮)が起こる可能性があります。特に、治療域が狭い薬剤(抗てんかん薬や抗不整脈薬など)において、剤形変更のルール上は可能であっても、安易な剤形変更がコントロール不良を引き起こすリスクがあることを、薬剤師は常に念頭に置くべきです。
次に、「感覚的拒絶」の問題です。錠剤はコーティングによって苦味がマスクされていますが、これを散剤に変更したり、OD錠に変更したりすることで、特有の苦味や甘味料の後味が露呈することがあります。特に認知症患者や小児において、「味が変わった」ことへの拒絶反応は強烈で、結果として服薬自体を拒否してしまう(アドヒアランスがゼロになる)リスクがあります。
剤形変更のルールで「変更できる」からといって、必ずしも変更することが正解とは限りません。実際には、「あえて変更せず、服薬ゼリーを併用する」あるいは「小粒の錠剤を探す」といったアプローチの方が、治療継続の観点からは優れている場合も多々あります。
さらに、OD錠(口腔内崩壊錠)への変更にも注意が必要です。OD錠は「水なしで飲める」ことがメリットですが、寝たきりの患者の場合、口腔内で崩壊した薬剤が喉に張り付いたり、誤嚥の原因になったりすることが報告されています。また、吸湿性が高いため一包化に適さないOD錠もあり、剤形変更のルールを適用して一包化した結果、薬が湿気で変質してしまうというトラブルも散見されます。このように、法的なルールだけでなく、製剤学的特性と患者の生活環境(保管状況や介助者の有無)までを総合的に評価して初めて、適切な剤形変更が可能となるのです。